细胞免疫疗法最早可追溯至1976年科学家Morgan利用白介素-2(IL-2)诱导LAK(Lymphokine Activated Killer)细胞治疗黑色素瘤、肺癌等多种恶性肿瘤。之后,历经TIL、CIK等疗法,最终迎来了新一代嵌合抗原受体(CAR)以及工程T细胞受体(TCR)技术,临床研究显示二者在抗肿瘤领域具有卓越的治疗效果。
随着2017年8月美国食品药品监督管理局(FDA)批准首个靶向CD19的嵌合抗原受体T细胞(CAR-T)产品——Tisagenlecleuce,用于治疗复发/难治性急性淋巴细胞白血病,细胞免疫疗法正式进入高速发展阶段。
目前,国内外研究热度高且已取得重大进展的细胞免疫疗法主要分为4类:TIL(肿瘤浸润淋巴细胞,Tumorinfiltratinglymphocytes)疗法、CAR-T疗法、CAR-NK疗法以及TCR疗法。

CAR-T中国上市引关注
2021年,2款CD19 CAR-T产品——阿基仑赛和瑞基奥仑赛——相继在中国获批上市,并因其高昂的治疗费用和优越的治疗效果而一度冲上热搜,被大家所熟知。
表1. 中国获批的CAR-T产品及其适应症(截至2023年2月20日)
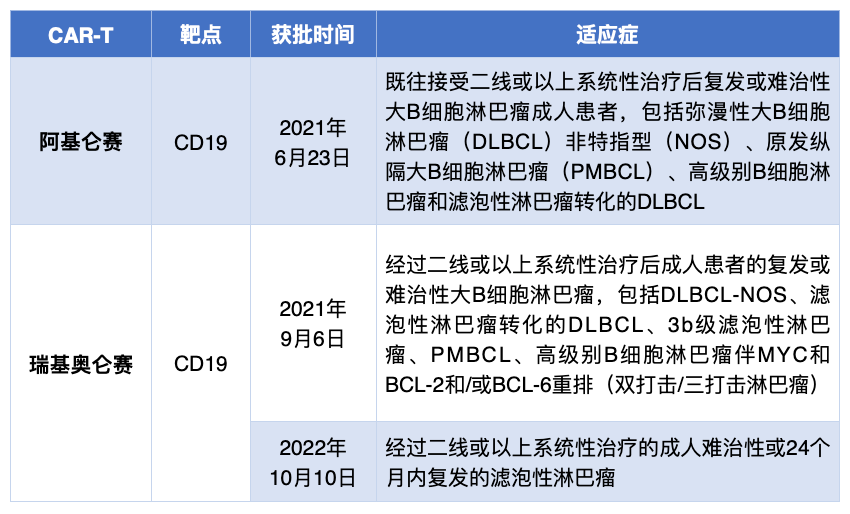 来源:国家药品监督管理局药品审评中心官网
来源:国家药品监督管理局药品审评中心官网
目前上市的CAR-T产品均是自体CAR-T,即采集患者自身的T细胞,在体外将其改造为可以识别并杀死肿瘤细胞的CAR-T细胞,最后经过扩增生产后将这些CAR-T细胞通过静脉输液的方式重新输回患者体内,发挥抗肿瘤作用。
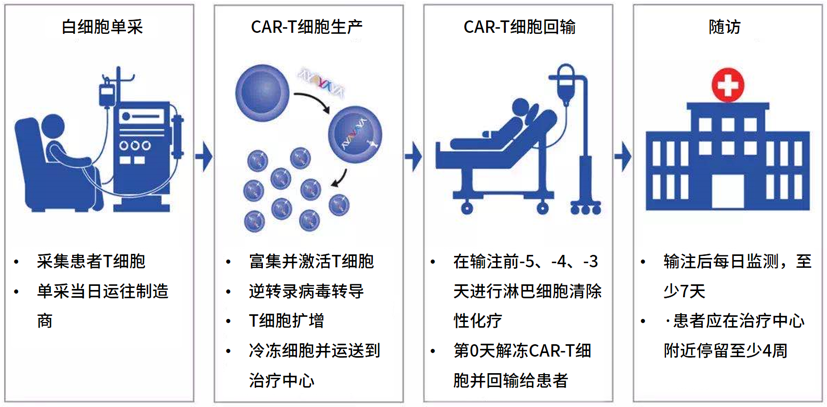
来源:JAMA Oncol. doi:10.1001/jamaoncol.2019.3869
现如今,细胞治疗产业已成为各国关注的重点产业,也是我国“十三五”规划中的重点发展产业之一。中国抗肿瘤新药经历了从无到有的艰难过程,已经逐步从仿制走向创新、从跟跑迈向领跑,进入肿瘤新药研发的黄金期,尤其是在细胞治疗领域,中国一直走在世界前列。截至2021年1月28日,通过clinicaltrail.gov网站检索,中国正在进行/已结束的CAR-T临床试验(排除终止和没有启动的试验)数量已经超过美国(219 vs 137),以研究者发起的研究(IIT)为主。
在21世纪的今天,CAR-T技术日新月异,已经出现了第5代产品——通用型CAR-T。通用型CAR-T顾名思义,又称异体CAR-T,它是使用来自健康志愿者的T细胞来生产CAR-T细胞。它能够突破个体限制,实现规模化生产和治疗,成本更低,能够让患者立即获得治疗,因此又称为"现货型"CAR-T。尽管目前全球范围内通用型CAR-T均处在临床研究阶段,还没有产品获批上市,但也为末线患者带来了生存希望。
除了技术的升级,CAR-T的靶点探索和适应症也有所拓展。除了已上市的用于治疗B细胞淋巴瘤的CD19 CAR-T以及2023年即将在国内获批用于治疗多发性骨髓瘤的BCMA CAR-T,还有很多新型靶点的CAR-T正在国内开展临床研究,例如:急性髓系白血病的CD33、胃肠道肿瘤的Claudin18.2(CLDN18.2)、肝癌的GPC3等靶点。除此之外,双靶点CAR-T甚至三靶点CAR-T的研发也正如火如荼,目前均处于临床前或临床研究阶段。
受人口老龄化加剧、生活方式改变及环境问题等因素影响,我国癌症患者人数在过去几年稳步上升,但是可供选择的有效治疗方案仍然有限。国内获批的CAR-T细胞疗法费用高昂,对患者造成了沉重的经济负担,而且适应症较少。因此,大部分可能获益于CAR-T的患者只能通过参与临床试验的途径接受相应的CAR-T治疗。